
Nuevo procedimiento para obtener amoniaco “más verde”
- Un nuevo procedimiento permite obtener amoníaco “más verde” mediante un sistema que utiliza menos energía
- Lo explica un artículo de Robert Sanders, Universidad de California – Berkeley, publicado por Phys.org
La producción industrial de amoníaco, principalmente para fertilizantes sintéticos -urea entre ellos-, el combustible de la Revolución Verde del siglo pasado, es uno de los mercados químicos más grandes del mundo, pero también uno de los que consumen más energía.
A nivel mundial, el proceso Haber-Bosch para producir amoníaco utiliza alrededor del 1 % de todos los combustibles fósiles y produce el 1 % de todas las emisiones de dióxido de carbono, lo que lo convierte en uno de los principales contribuyentes al cambio climático.
Ahora, los químicos de la Universidad de California, Berkeley, han dado un gran paso para hacer que la producción de amoníaco sea más respetuosa con el medio ambiente: un amoníaco “más verde” para un fertilizante “más verde”.
El desafío
Un obstáculo importante para producir amoníaco con menos consumo de energía ha sido separar el amoníaco de los reactivos, principalmente nitrógeno e hidrógeno, sin los grandes cambios de temperatura y presión que requiere el proceso Haber-Bosch. Esa reacción tiene lugar entre aproximadamente 300 y 500 grados Celsius, pero el amoníaco se elimina enfriando el gas a aproximadamente -20 C, momento en el cual el amoníaco gaseoso se condensa como líquido. El proceso también requiere presurizar los reactivos a aproximadamente 150-300 veces la presión atmosférica. Todo esto requiere energía de combustibles fósiles.
La búsqueda de alternativas
Los métodos alternativos para la separación de amoníaco podrían abrir la puerta a procesos alternativos que operen en condiciones menos extremas. Para abordar este problema, los químicos de UC Berkeley diseñaron y sintetizaron materiales porosos (estructuras orgánicas de metal o MOF, metal organic frameworks) que se unen y liberan amoníaco a presiones y temperaturas moderadas alrededor de 175 C. Debido a que el MOF no se une a ninguno de los reactivos, el la captura y liberación de amoníaco se puede lograr con cambios de temperatura más pequeños, lo que ahorra energía.
“Un gran desafío para descarbonizar la producción de fertilizantes es encontrar un material donde se pueda capturar y luego liberar grandes cantidades de amoníaco, idealmente con un aporte mínimo de energía”, dijo Benjamin Snyder, becario postdoctoral de UC Berkeley, quien dirigió la investigación. “Es decir, no se quiere tener que poner mucho calor en su material para forzar la salida del amoníaco y, de la misma manera, cuando el amoníaco se absorbe, no se quiere que eso genere muchos desechos. calor.”
Una ventaja clave de un proceso que opera a temperaturas y presiones más bajas es que el amoníaco y, por lo tanto, el fertilizante, podrían producirse en instalaciones más pequeñas más cercanas a los agricultores, incluso en el sitio de la granja, en lugar de grandes plantas químicas centralizadas.
“El sueño aquí sería habilitar una tecnología en la que un agricultor en alguna zona económicamente desfavorecida del mundo ahora tenga un acceso mucho más fácil al amoníaco que necesita para cultivar sus cultivos”, dijo Snyder. “Para ser claros, nuestro material no ha resuelto ese problema por completo. Pero hemos presentado una nueva forma de pensar sobre cómo se pueden usar estructuras metalorgánicas en el contexto de la captura de amoníaco para un proceso Haber-Bosch modificado. Creo que este estudio representa un avance conceptual muy importante en esa dirección”.
Snyder y Jeffrey Long, autor principal del artículo y profesor de química de ingeniería química y biomolecular de UC Berkeley, publican los detalles de su estudio MOF en la revista Nature. Este mes, enero 2023, Snyder se unió al departamento de química de la Universidad de Illinois Urbana-Champaign como profesor asistente.
“Este trabajo es de fundamental importancia porque revela un nuevo mecanismo cooperativo para la captura selectiva de gas”, dijo Long, profesor distinguido de C. Judson King en UC Berkeley y científico de la facultad en el Laboratorio Nacional Lawrence Berkeley. “Somos optimistas de que el mecanismo se extenderá a otras moléculas de importancia industrial que tienen una fuerte afinidad por la unión de metales”.
Un proceso Haber-Bosch “verde”
Según Snyder, muchos investigadores están trabajando en formas de hacer que el proceso Haber-Bosch, que data de principios del siglo XX, sea más sostenible. Esto incluye la producción de un reactivo importante, el hidrógeno, usando energía solar para dividir el agua en hidrógeno y oxígeno. Hoy en día, el hidrógeno se obtiene normalmente del gas natural, que es principalmente metano, en una reacción que libera dióxido de carbono, el gas de efecto invernadero dominante.
Otras modificaciones ecológicas incluyen nuevos catalizadores que funcionan a temperaturas y presiones más bajas para hacer reaccionar el hidrógeno con nitrógeno, normalmente capturado del aire, para formar amoníaco, NH3.
Pero eliminar el amoníaco de la mezcla después de la reacción sigue siendo difícil. Otros materiales porosos, como las zeolitas, no pueden absorber y liberar grandes cantidades de amoníaco. Y otros MOF que las personas probaron a menudo se desintegraron en presencia de amoníaco, que es altamente corrosivo.
La innovación de Snyder fue probar una variedad relativamente nueva de MOF que emplea átomos de cobre unidos por moléculas orgánicas llamadas ciclohexanodicarboxilato para crear los MOF rígidos y de estructura muy porosa.
Para su sorpresa, el amoníaco no destruyó este MOF, sino que lo convirtió en hilos de un polímero que contiene cobre y amoníaco con una densidad extremadamente alta de amoníaco almacenado. Además, las hebras de polímero cedieron fácilmente su amoníaco a temperaturas relativamente bajas, restaurando el material a su estructura inicial, un MOF poroso y rígido.
“Cuando expones este marco al amoníaco, cambia completamente su estructura”, dijo. “Empieza como un material tridimensional poroso y, al exponerse al amoníaco, en realidad se desteje y forma lo que yo llamaría un polímero unidimensional. Piense en ello como un manojo de cuerdas. Este mecanismo de adsorción realmente inusual permite absorbamos grandes cantidades de amoníaco“.
En el proceso inverso, agregó, “el polímero de alguna manera se tejerá de nuevo en un marco tridimensional cuando se elimina el amoníaco, que creo que es una de las características más llamativas de este material”.
Snyder descubrió que el MOF podía ajustarse para absorber y liberar amoníaco bajo una amplia gama de presiones, haciéndolo más adaptable a cualquier condición de reacción que resulte ser la mejor para producir amoníaco de manera más eficiente a partir de reactivos sostenibles.
“El beneficio de nuestros MOF es que hemos descubierto que se pueden ajustar, lo que significa que si terminan bloqueando un determinado conjunto de condiciones de reacción en un proceso específico, podemos modificar los parámetros de rendimiento del MOF: la temperatura que usa y la presión que usa para este adsorbente, para que coincida estrechamente con la aplicación específica”.
Snyder enfatizó que la captura de amoníaco es solo una parte de cualquier proceso modificado para hacer amoníaco más ecológico, que aún es un trabajo en progreso.
“Hay mucha gente inteligente pensando en el diseño de catalizadores y reactores para un proceso Haber Bosch modificado que está diseñado para operar bajo temperaturas y presiones más moderadas”, dijo Snyder.
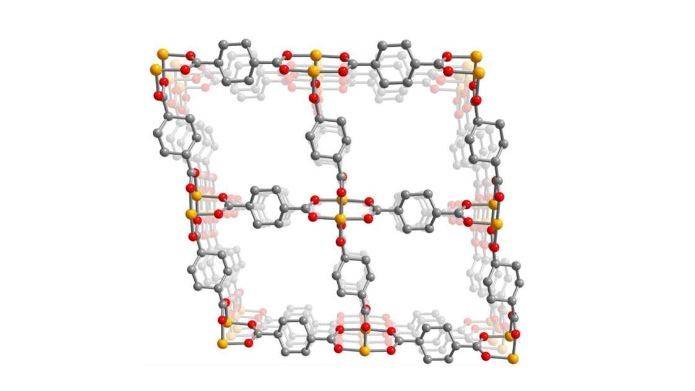
La imagen es una sección transversal a través de una estructura porosa metal-orgánica que muestra los átomos de cobre (amarillo) que están enmarcados en una estructura rígida formada por moléculas enlazadoras orgánicas, ciclohexanodicarboxilato, que contienen oxígeno (rojo) y carbono (gris). El amoníaco rompe los enlaces cobre-oxígeno en este marco 3D, lo que hace que se transforme en un polímero unidimensional. El marco 3D poroso luego se vuelve a ensamblar a medida que se elimina el amoníaco. Crédito: laboratorio Jeffrey Long, UC Berkeley
Fuente
Toward ‘green’ ammonia and a ‘greener’ fertilizer: New MOFs use less energy to separate ammonia from chemical reactants
Robert Sanders, University of California – Berkeley
https://phys.org/journals/nature/
Noticias relacionadas




























